آخرین مطالب
امکانات وب
از ویکیپدیا، دانشنامه آزاد
چرخه کارنو یک چرخه ترمودینامیکی ایده آل است که توسط فیزیکدان فرانسوی سادی کارنو در سال 1824 پیشنهاد شد و توسط دیگران در دهه های 1830 و 1840 گسترش یافت. با قضیه کارنو ، حد بالایی را برای بازده هر موتور ترمودینامیکی کلاسیک در طول تبدیل گرما به کار ، یا برعکس، کارایی یک سیستم تبرید در ایجاد اختلاف دما از طریق اعمال کار بر روی سیستم، فراهم میکند.
در چرخه کارنو، یک سیستم یا موتور انرژی را به شکل گرما بین دو مخزن حرارتی در دماها منتقل می کند.تیاچ




جایی که
چرخه کارنو به عنوان یک چرخه ترمودینامیکی ایده آل که توسط موتور حرارتی کارنو انجام می شود ، شامل مراحل زیر است:

انبساط همدما . گرما (به عنوان یک انرژی) به طور برگشت پذیر از مخزن دمای داغ در دمای ثابت TH به گاز در دمای بینهایت کمتر از TH منتقل می شود (تا امکان انتقال گرما به گاز بدون تغییر عملاً دمای گاز بنابراین اضافه یا جذب گرمای همدما فراهم شود ). در طی این مرحله (1 تا 2 در شکل 1 ، A تا B در شکل 2 )، گاز از نظر حرارتی با مخزن دمای داغ در تماس است (در حالی که از نظر حرارتی از مخزن دمای سرد جدا شده است) و گاز اجازه انبساط داده و کار را انجام می دهد. روی محیط اطراف با فشار دادن گاز پیستون به سمت بالا (شکل مرحله 1، سمت راست). اگرچه فشار از نقاط 1 تا 2 کاهش می یابد (شکل 1) دمای گاز در طول فرآیند تغییر نمی کند زیرا گرمای منتقل شده از مخزن دمای داغ به گاز دقیقاً برای انجام کار بر روی محیط اطراف توسط گاز استفاده می شود. بدون تغییر انرژی داخلی گاز (بدون تغییر دمای گاز برای یک گاز ایده آل). گرمای QH > 0 از مخزن دمای داغ جذب می شود و در نتیجه آنتروپی افزایش می یابد .
گاز بر حسب مقدار
.
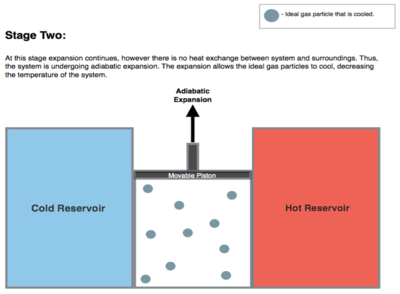
انبساط ایزنتروپیک ( آدیاباتیک برگشت پذیر ) گاز (خروجی کار ایسنتروپیک). برای این مرحله (2 تا 3 در شکل 1 ، B تا C در شکل 2 ) گاز موجود در موتور از هر دو مخزن سرد و گرم عایق حرارتی می شود، بنابراین آنها نه گرما را دریافت می کنند و نه از دست می دهند، یک فرآیند " آدیاباتیک ". گاز با کاهش فشار خود به انبساط ادامه می دهد، کار روی محیط اطراف انجام می دهد (بالا بردن پیستون؛ مرحله 2 شکل، سمت راست)، و مقداری از انرژی داخلی را از دست می دهد که برابر با کار انجام شده است. انبساط گاز بدون ورودی گرما باعث سرد شدن گاز به دمای "سرد" می شود (با از دست دادن انرژی داخلی خود) که بی نهایت بالاتر از دمای مخزن سرد T C است . آنتروپی بدون تغییر باقی میماند زیرا هیچ گرمایی Q بین سیستم (گاز) و محیط اطراف آن منتقل نمیشود، بنابراین یک فرآیند ایزنتروپیک، به معنی عدم تغییر آنتروپی در فرآیند).

فشرده سازی ایزوترمال. گرما به طور برگشت پذیر به مخزن دمای پایین در دمای ثابت T C (دفع حرارت همدما) منتقل می شود. در این مرحله (3 تا 4 در شکل 1 ، C تا D در شکل 2 )، گاز موتور در تماس حرارتی با مخزن سرد در دمای T C (در حالی که از نظر حرارتی از مخزن دمای داغ جدا شده است) و دمای گاز است. بی نهایت بالاتر از این دما است (برای انتقال حرارت از گاز به مخزن سرد بدون تغییر عملا دمای گاز). محیط اطراف روی گاز کار می کند و پیستون را به سمت پایین فشار می دهد (شکل مرحله 3، سمت راست). مقداری از انرژی که توسط گاز حاصل از این کار به دست می آید دقیقاً به عنوان انرژی گرمایی Q C 0 (منفی به عنوان خروج از سیستم، طبق قرارداد جهانی در ترمودینامیک ) به مخزن سرد منتقل می شود، بنابراین آنتروپی سیستم کاهش می یابد. میزان
. [1]
زیرا فشردگی همدما باعث کاهش تعدد گاز می شود.

فشرده سازی ایزنتروپیک. (4 به 1 در شکل 1 ، D تا A در شکل 2 ) یک بار دیگر گاز موجود در موتور از نظر حرارتی از مخازن سرد و گرم عایق می شود و موتور بدون اصطکاک فرض می شود و فرآیند به اندازه کافی کند است، بنابراین برگشت پذیر است. در طی این مرحله، محیط اطراف روی گاز کار می کند، پیستون را بیشتر به سمت پایین فشار می دهد (مرحله 4 شکل، سمت راست)، انرژی داخلی آن را افزایش می دهد، آن را فشرده می کند و باعث می شود که دمای آن به دمای بی نهایت کمتر از TH برگردد . به کار اضافه شده به سیستم، اما آنتروپی بدون تغییر باقی می ماند. در این مرحله گاز در همان حالت ابتدای مرحله 1 قرار دارد.
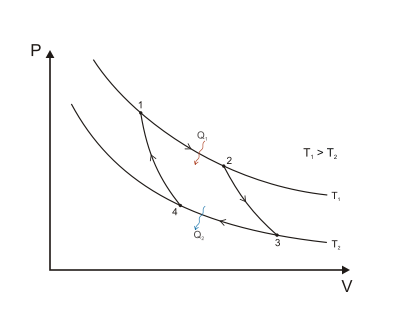
شکل 1 : چرخه کارنو که بر روی یک نمودار PV برای نشان دادن کار انجام شده نشان داده شده است. 1-به-2 (انبساط همدما)، 2-به-3 (انبساط ایسنتروپیک)، 3-به-4 (فشرده سازی همدما)، 4-به-1 (فشرده سازی ایسنتروپیک).
در این حالت، از آنجایی که یک چرخه ترمودینامیکی برگشت پذیر است (بدون تغییر خالص در سیستم و محیط اطراف آن در هر سیکل) [2] [1]

این درست است به عنوان


نمودار فشار-حجم [ ویرایش ]
هنگامی که یک چرخه کارنو بر روی نمودار فشار-حجم رسم می شود ( شکل 1 )، مراحل همدما از خطوط همدما برای سیال عامل پیروی می کنند، مراحل آدیاباتیک بین ایزوترم ها حرکت می کنند و ناحیه محدود شده توسط مسیر چرخه کامل، کل کار را نشان می دهد. را می توان در یک چرخه انجام داد. از نقطه 1 تا 2 و نقطه 3 تا 4 دما ثابت است (فرایند همدما). انتقال حرارت از نقطه 4 به 1 و نقطه 2 به 3 برابر با صفر است (فرایند آدیاباتیک).
خواص و اهمیت [ ویرایش ]
نمودار دما – آنتروپی [ ویرایش ]
مقاله اصلی: نمودار دما – آنتروپی

شکل 2 : یک چرخه کارنو به عنوان یک چرخه ترمودینامیکی ایده آل که توسط یک موتور حرارتی کارنو انجام می شود ، که بر روی نمودار TS (دما آنتروپی T-S) نشان داده شده است. چرخه بین یک مخزن گرم در دمای T H و یک مخزن سرد در دمای T C انجام می شود . محور عمودی دمای سیستم و محور افقی آنتروپی سیستم است. A-to-B (انبساط همدما)، B-to-C (انبساط ایسنتروپیک)، C-to-D (فشرده سازی همدما)، D-to-A (فشرده سازی ایسنتروپیک).

شکل 3 : یک چرخه ترمودینامیکی تعمیم یافته که بین یک مخزن داغ در دمای TH و یک مخزن سرد در دمای TC انجام می شود . طبق قانون دوم ترمودینامیک ، چرخه نمی تواند در خارج از باند دما از TC تا TH گسترش یابد . منطقه به رنگ قرمز، | Q C |، مقدار انرژی مبادله شده بین سیستم و مخزن سرد است. مساحت سفید W مقدار انرژی کاری است که سیستم با محیط اطرافش مبادله می کند. مقدار حرارت مبادله شده با مخزن داغ مجموع این دو است. اگر سیستم مانند یک موتور رفتار کند، فرآیند در جهت عقربههای ساعت در اطراف حلقه حرکت میکند و اگر مانند یک یخچال رفتار کند در خلاف جهت عقربههای ساعت حرکت میکند. بازده به چرخه، نسبت ناحیه سفید (کار) تقسیم بر مجموع نواحی سفید و قرمز (گرمای جذب شده از مخزن داغ) است. Q C (انرژی از دست رفته به مخزن سرد) را می توان به عنوان یک تفریق مستقیم یا به صورت مجموع یک کمیت منفی بیان کرد که می تواند به قراردادهای مختلفی منجر شود.
رفتار موتور یا یخچال کارنو با استفاده از نمودار دما- آنتروپی ( نمودار T - S ) که در آن حالت ترمودینامیکی با نقطه ای از نمودار با آنتروپی ( S ) به عنوان محور افقی و دما مشخص می شود، بهتر درک می شود. T ) به عنوان محور عمودی ( شکل 2 ). برای یک سیستم بسته ساده (تجزیه و تحلیل جرم کنترل)، هر نقطه در نمودار نشان دهنده وضعیت خاصی از سیستم است. یک فرآیند ترمودینامیکی با یک منحنی نشان داده می شود که حالت اولیه (A) و حالت نهایی (B) را به هم متصل می کند. مساحت زیر منحنی عبارت است از:
( 1 ) |
که مقدار گرمای منتقل شده در فرآیند است. اگر فرآیند سیستم را به سمت آنتروپی بیشتر سوق دهد، سطح زیر منحنی مقدار گرمای جذب شده توسط سیستم در آن فرآیند است. در غیر این صورت، مقدار گرمایی است که از سیستم خارج می شود یا از آن خارج می شود. برای هر فرآیند چرخه ای، یک بخش بالایی از چرخه و یک بخش پایین تر وجود دارد. در نمودارهای T - S برای یک چرخه جهت عقربه های ساعت، ناحیه زیر قسمت بالایی انرژی جذب شده توسط سیستم در طول چرخه خواهد بود، در حالی که ناحیه زیر قسمت پایین انرژی حذف شده از سیستم در طول چرخه خواهد بود. سپس مساحت داخل چرخه تفاوت بین این دو (انرژی گرمای خالص جذب شده) است، اما از آنجایی که انرژی داخلی سیستم باید به مقدار اولیه خود بازگشته باشد، این تفاوت باید مقدار کار انجام شده توسط سیستم در هر چرخه باشد. . با مراجعه به شکل 1 ، از نظر ریاضی، برای یک فرآیند برگشت پذیر، ممکن است مقدار کار انجام شده در یک فرآیند چرخه ای را به صورت زیر بنویسیم:
( 2 ) |
از آنجایی که dU یک دیفرانسیل دقیق است ، انتگرال آن بر روی هر حلقه بسته صفر است و نتیجه آن این است که مساحت داخل حلقه در نمودار T - S برابر است با کل کار انجام شده توسط سیستم بر روی محیط اطراف اگر حلقه باشد. در جهت عقربههای ساعت پیمایش میشود، و (ب) برابر است با کل کار انجام شده روی سیستم توسط محیط اطراف، زیرا حلقه در جهت خلاف جهت عقربههای ساعت پیمایش میشود.

شکل 4 : چرخه کارنو که بین یک مخزن گرم در دمای TH و یک مخزن سرد در دمای TC انجام می شود .
چرخه کارنو [ ویرایش ]
شکل 5 : تجسم یک چرخه کارنو
ارزیابی انتگرال فوق به ویژه برای یک چرخه کارنو ساده است. مقدار انرژی منتقل شده به عنوان کار است
مقدار کل گرمای منتقل شده از مخزن گرم به سیستم (در انبساط همدما) خواهد بود.

به دلیل حفظ انرژی، گرمای خالص منتقل شده،
کارایی
( 3 ) |
جایی که
بیان با دما




این تعریف راندمان کار موتور حرارتی کارنو به عنوان کسری از کار انجام شده توسط سیستم به انرژی حرارتی دریافتی سیستم از مخزن داغ در هر سیکل است. این انرژی حرارتی آغازگر چرخه است.
چرخه کارنو معکوس [ ویرایش ]
یک چرخه موتور حرارتی کارنو که شرح داده شد یک چرخه کاملاً برگشت پذیر است. یعنی تمام فرآیندهای تشکیل دهنده آن را می توان معکوس کرد که در این صورت تبدیل به پمپ حرارتی و چرخه تبرید کارنو می شود . این بار، چرخه دقیقاً یکسان می ماند با این تفاوت که جهت هر گونه فعل و انفعالات حرارتی و کاری معکوس می شود. گرما از مخزن با دمای پایین جذب میشود، گرما به مخزن با دمای بالا دفع میشود و برای انجام همه اینها یک ورودی کاری لازم است. نمودار P - V چرخه معکوس کارنو مانند چرخه موتور حرارتی کارنو است با این تفاوت که جهت فرآیندها معکوس است. [3]
قضیه کارنو [ ویرایش ]
مقاله اصلی: قضیه کارنو (ترمودینامیک)
از نمودار بالا می توان دریافت که برای هر چرخه ای که بین دماها کار می کند

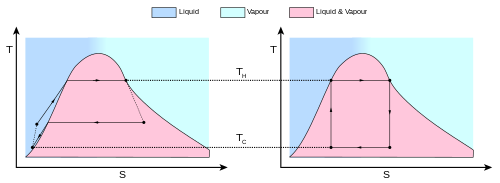
شکل 6 : یک موتور واقعی (سمت چپ) در مقایسه با چرخه کارنو (راست). آنتروپی یک ماده واقعی با دما تغییر می کند. این تغییر با منحنی در نمودار T - S نشان داده می شود . برای این شکل، منحنی یک تعادل بخار-مایع را نشان می دهد ( به چرخه رانکین مراجعه کنید ). سیستم های برگشت ناپذیر و تلفات انرژی (مثلاً کار در اثر اصطکاک و تلفات حرارتی) مانع از تحقق ایده آل در هر مرحله می شود.
قضیه کارنو بیانیه رسمی این واقعیت است: هیچ موتوری که بین دو مخزن حرارتی کار می کند نمی تواند کارآمدتر از موتور کارنو بین همان مخازن باشد. بنابراین، معادله 3 حداکثر بازده ممکن را برای هر موتوری با استفاده از دماهای مربوطه نشان می دهد. نتیجهای از قضیه کارنو بیان میکند که: همه موتورهای برگشتپذیر که بین مخازن حرارتی یکسانی کار میکنند به یک اندازه کارآمد هستند. تنظیم مجدد سمت راست معادله شکل سادهتری از معادله را به دست میدهد، یعنی اینکه حداکثر بازده نظری یک موتور حرارتی برابر است با اختلاف دمای بین مخزن سرد و گرم تقسیم بر دمای مطلق مخزن گرم. . با نگاهی به این فرمول یک واقعیت جالب آشکار می شود: کاهش دمای مخزن سرد تاثیر بیشتری بر بازده سقف یک موتور حرارتی خواهد داشت تا اینکه دمای مخزن داغ را به همان میزان افزایش دهد. در دنیای واقعی، دستیابی به این امر ممکن است دشوار باشد زیرا مخزن سرد اغلب دمای محیط موجود است.
به عبارت دیگر، حداکثر بازده در صورتی به دست می آید که آنتروپی در هر چرخه تغییر نکند. تغییر آنتروپی در هر چرخه ایجاد می شود، برای مثال، اگر اصطکاک وجود داشته باشد که منجر به اتلاف کار به گرما شود. در این صورت، چرخه برگشت پذیر نیست و قضیه کلازیوس به جای برابری تبدیل به نابرابری می شود. در غیر این صورت، از آنجایی که آنتروپی یک تابع حالت است ، تخلیه گرمای مورد نیاز به محیط برای دفع آنتروپی اضافی منجر به کاهش (حداقل) راندمان می شود. بنابراین معادله 3 کارایی هر موتور حرارتی برگشت پذیر را نشان می دهد .
در موتورهای حرارتی مزوسکوپی، کار در هر چرخه عملیات به طور کلی به دلیل نویز حرارتی در نوسان است. اگر چرخه به صورت شبه ایستا انجام شود، نوسانات حتی در مقیاس مزو مقیاس ناپدید می شوند. [4] با این حال، اگر چرخه سریعتر از زمان استراحت محیط کار انجام شود، نوسانات کار اجتناب ناپذیر است. با این وجود، هنگامی که نوسانات کار و گرما شمارش می شود، یک برابری دقیق میانگین نمایی کار انجام شده توسط هر موتور حرارتی را به انتقال حرارت از حمام حرارتی گرمتر مرتبط می کند. [5]
کارایی موتورهای حرارتی واقعی [ ویرایش ]
همچنین ببینید: موتور حرارتی § راندمان
کارنو متوجه شد که در واقعیت، ساخت یک موتور ترمودینامیکی برگشت پذیر امکان پذیر نیست . بنابراین، موتورهای حرارتی واقعی حتی کمتر از آنچه در معادله 3 نشان داده شده است، کارآمد هستند . علاوه بر این، موتورهای واقعی که در امتداد سبک چرخه کارنو (انبساط همدما / انبساط ایزوتروپیک / تراکم همدما / تراکم ایزنتروپیک) کار می کنند نادر هستند. با این وجود، معادله 3 برای تعیین حداکثر بازدهی که میتوان برای مجموعه معینی از مخازن حرارتی انتظار داشت، بسیار مفید است.
اگرچه چرخه کارنو یک ایده آل سازی است، اما رابطه 3 به عنوان بیان کارایی کارنو هنوز مفید است. دمای متوسط را در نظر بگیرید ،

برای چرخه کارنو یا معادل آن، مقدار متوسط 〈 T H 〉 برابر با بالاترین دمای موجود، یعنی T H و 〈 T C 〉 کمترین، یعنی T C خواهد بود . برای سایر چرخههای ترمودینامیکی کمتر کارآمد، 〈 T H 〉 کمتر از T H و 〈 T C 〉 بالاتر از T C خواهد بود . به عنوان مثال، این می تواند نشان دهد که چرا یک گرم کننده یا احیاء کننده می تواند بازده حرارتی نیروگاه های بخار را بهبود بخشد و چرا راندمان حرارتی نیروگاه های سیکل ترکیبی (که دارای توربین های گازی هستند که در دماهای بالاتر کار می کنند) از بخار معمولی فراتر می رود. گیاهان اولین نمونه اولیه موتور دیزل بر اساس اصول چرخه کارنو بود.
به عنوان یک ساختار ماکروسکوپی [ ویرایش ]
مقاله اصلی: موتور حرارتی کارنو § به عنوان یک ساختار ماکروسکوپی
موتور حرارتی کارنو ، در نهایت، یک ساختار نظری است که بر اساس یک سیستم ترمودینامیکی ایده آل است . در سطح عملی در مقیاس انسانی، چرخه کارنو یک مدل با ارزش است، مانند پیشرفت در توسعه موتور دیزل . با این حال، در مقیاس ماکروسکوپی، محدودیتهای اعمال شده توسط مفروضات مدل، غیرعملی بودن و در نهایت ناتوانی در انجام هر کاری را ثابت میکند . [6] به این ترتیب، طبق قضیه کارنو ، موتور کارنو ممکن است به عنوان حد نظری موتورهای حرارتی در مقیاس ماکروسکوپی در نظر گرفته شود تا هر وسیله عملی که میتوان ساخت. [7]
همچنین ببینید [ ویرایش ]
یادداشت
- ^پرش به بالا:a b c Planck, M. (1945). معادلات 39، 40 و 65 در بخشهای 90 و 137. رساله ترمودینامیک . انتشارات دوور. ص 75، 135.
- ↑ فرمی، ای. (1956). "معادله 64". ترمودینامیک (PDF) . انتشارات دوور. پ. 48.
- ↑ چنگل، یونس آ، و مایکل ای. بولز. ترمودینامیک: یک رویکرد مهندسی . ویرایش هفتم نیویورک: مک گراو هیل، 2011. ص. 299. چاپ.
- ↑ Holubec Viktor and Ryabov Artem (2018). "دوچرخه نوسانات قدرت را نزدیک به راندمان بهینه کاهش می دهد". فیزیک کشیش لِت 121 (12): 120601. arXiv : 1805.00848 . Bibcode : 2018PhRvL.121l0601H . doi : 10.1103/PhysRevLett.121.120601 . PMID 30296120 . S2CID 52943273 .
- ↑ NA Sinitsyn (2011). "رابطه نوسانات برای موتورهای حرارتی". J. Phys. ج: ریاضی نظریه . 44 (40): 405001. arXiv : 1111.7014 . Bibcode : 2011JPhA...44N5001S . doi : 10.1088/1751-8113/44/40/405001 . S2CID 119261929 .
- ^ لیو، آویزان. منگ، شین-هه (18 اوت 2017). "اثرات انرژی تاریک بر کارایی سیاهچاله های AdS باردار به عنوان موتورهای حرارتی" . مجله فیزیکی اروپا C. 77 (8): 556. arXiv : 1704.04363 . doi : 10.1140/epjc/s10052-017-5134-9 . ISSN 1434-6052 . ... از آنجایی که موتور حرارتی کارنو، تعیین حد بالایی بر روی بازده موتور حرارتی یک موتور ایده آل و برگشت پذیر است که یک چرخه آن باید در زمان بی نهایت انجام شود که غیرعملی است و بنابراین موتور کارنو قدرت صفر دارد.
- ↑ بننتی، جولیانو؛ کاساتی، جولیو؛ وانگ، جیائو (2020). "قدرت، راندمان، و نوسانات در موتورهای حرارتی حالت پایدار" (PDF) . بررسی فیزیکی E. 102 (4). با این حال، نوسانات [در دمای مخزن] چنین موتورهایی را غیرعملی می کند.
منابع
پیوندهای خارجی [ ویرایش ]
https://en.wikipedia.org/wiki/Carnot_cycle
ریاضیات...برچسب : نویسنده : 9math1342d بازدید : 75








